notice : 본 문서는 MEDDEV 2.7/1_rev4를 기준으로 작성되었음을 알립니다.
임상 평가는 임상 안전 데이터를 포함하여 기기의 의도된 목적 (Intended Use)과 관련된 시판 전, 시판 후 임상 데이터의 분석을 기반으로 한다.
임상 평가는 적절한 자격을 갖춘 개인 또는 팀에 의해 수행되어야 한다. 평가자에게는 다음과 같은 지식이 요구한다.
-연구 방법론 (임상 조사 설계 및 생물 통계 포함);
-정보 관리 (예 : 과학적 배경 또는 사서 자격, Embase 및 Medline과 같은 관련 데이터베이스에 대한 경험)
-규제 요건
-의학 관련 문서 작성 (예 : 관련 과학 또는 의학 분야의 대학원 경험, 의학 문서 작성 교육 및 경험, 체계적인 검토 및 임상 데이터 평가).
이뿐 아니라 평가중인 기기에 대해서도 추가로 지식을 요한다.
-장치 기술 및 그 응용
-기기에 의해 진단 또는 관리 될 상태의 진단 및 관리, 의료 대안에 대한 지식, 치료 표준 및 기술 (예 : 관련 의료 전문 분야의 전문 임상 전문 지식).
이에 대한 지식과는 별개로 다음의 자격요건을 요구한다.
-해당 분야의 고등 교육 학위 및 문서화 된 전문 경력 5 년
또는
-학위가 주어진 과제에 대한 전제 조건이 아닌 경우 10 년의 문서화 된 전문 경험.
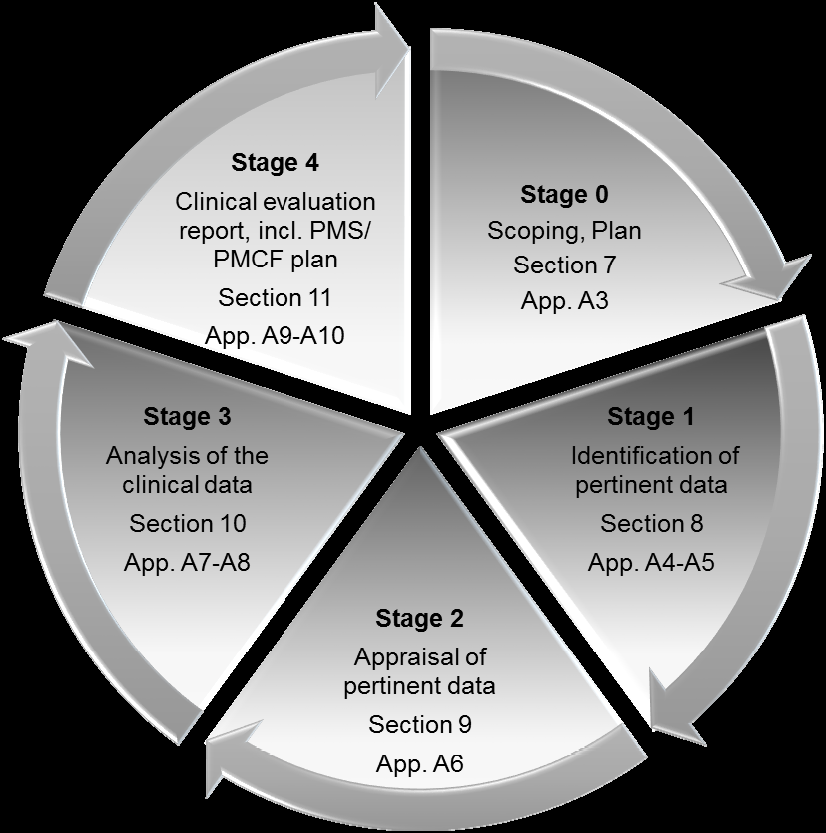
임상 평가는 다음과 같은 절차를 거쳐 진행된다.
0 단계 : 범위 정의 및 임상 평가 계획
임상 평가를 수행하기 전에 제조업체는 임상적 관점에서 다루어야 하는 필수 요구 사항과 장치의 특성 및 이력에 따라 범위를 지정해야한다. 이는 인증받고자 하는 장비 종류, 특성에 따라 다르기 때문에 이미 시판 된 장비를 참고하는 것이 좋다. 임상 평가의 경우, 그 결과가 유리하던 불리하던 모두 식별, 평가 및 분석이 진행되어야 한다.
1 단계 : 관련 데이터 식별
관련 데이터 식별은 두가지 방법이 있다. 제조사에서 직접 임상 평가를 주도하여 데이터를 확보하는 방법과 논문, 문헌 등에서 관련 임상 데이터를 확보하는 방법이다. 임상을 직접하는 경우엔 위험 관리, PMS에 대한 정보, 부작용 보고 등의 정보를 포함해야한다.
문헌을 통한 임상 데이터의 확보의 경우 동등성 입증이 가장 중요하다. 평가중인 기기가 해당 문헌의 기기와 동일 성능, 동일한 목적, 동일한 조건인지를 입증하고 해당 임상 데이터가 평가 기기에 적용이 가능한지에 대한 입증이 중요하다.
임상 데이터는 동일한 성능의 장비임도 중요하지만 임상 대상의 조건도 중요하다. (인종, 나이 등)
일반적으로 실제로 임상을 한다면 팔로우 기간까지 포함한다면 최소 6개월에서 2년까지 걸리고 비용도 비용이기 때문에... 문헌을 통한 임상데이터를 주로 사용한다.
논문의 검색 방법, 선정 방법에 대한 문서를 작성하면 된다.
2 단계 : 과학적 타당성, 관련성 및 가중치 측면에서 데이터 평가
1 단계에서 식별 된 데이터의 가치를 결정하기 위해 평가자는 기기의 임상 성능 및 임상 안전성 평가에 대해 각 개별 문서를 평가해야한다.
임상 평가 데이터가 방법론적, 과학적으로 타당한지, 임상평가에 대한 정보가 관련성이 있는지 등을 점수를 매겨 문서를 선정한다.
MEDDEV 2.7/1 rev 4의 24 페이지를 확인하면 예시를 확인할 수 있다.
점수를 책정하는 방법은 의료기기가 다양하기 때문에 획일화된 방법은 없다. 이에 평가자는 특정 평가에 적용할 기준을 잘 정해야 하며 사전에 정의된 기준을 평가자는 엄격하게 엄수하며 평가를 진행하여야 한다. 예시로, 임상 데이터가 무작위 대조 임상 시험일 때 가장 높은 점수를 매긴다.
3 단계 : 데이터 분석 후 결론 도출
기기의 목적에 따라 기기의 임상 성능 및 안전성과 관련된 각 필수 요구 사항의 준수를 종합적으로 판단한다. 이를 판단하기 위해서 평가자는 다음을 수행한다.
• use sound methods;
• make a comprehensive analysis;
• determine if additional clinical investigations or other measures are necessary;
• determine PMCF needs.
이에 대한 내용은 MEDDEV 2.7/1 rev 4의 27 페이지를 확인해보자.
4 단계 : 임상 평가 보고서 완성
임상 평가 보고서는 앞서 분석한 데이터와 그 결과를 문서화하기 위해 작성한다. 임상 평가 보고서는 NB가 읽고 이해할 수 있는 충분한 정보가 포함되어야 한다. 합당한 이유없이 그냥 이렇습니다...하면 바로 빠꾸먹는다.
또한 평가자가 채택한 검색 기준, 사용 가능한 데이터, 모든 가정 및 모든 결론을 포함되어야 한다. 이에 대해 이를 뒷받침하는 관련 문서와 상호 참조되어야 한다.
분량은 기기나 기술에 대한 역사나 관련 이론에 따라 다를 수 있다. 분량에 너무 신경쓰지말자.(일단 다 넣자)
만약 평가 기기가 새로운 기술이나 기기일 경우 개발 과정에 대한 개요와 모든 임상 데이터가 포함되어야 한다.
다음은 임상 평가를 도식화한 그림이다.
'Clinical > CER' 카테고리의 다른 글
| 3. CER 작성을 위한 목차 설정 (0) | 2020.11.04 |
|---|---|
| 1. 약어 정리 및 설명 (0) | 2020.10.30 |
| 0. Introduction (0) | 2020.10.29 |


